Immer häufiger verursachen Fettlebererkrankungen (sogenannte steatotische Lebererkrankungen, kurz SLD) ein Versagen des lebenswichtigen Organs Leber. Ein Team unter Leitung von Forschenden des Instituts für Stoffwechselphysiologie der Heinrich-Heine-Universität Düsseldorf (HHU) in Zusammenarbeit mit dem Deutschen Diabetes-Zentrum (DDZ) und weiteren Partnern hat nun herausgefunden, dass eine bestimmte Fettsäure in Blutgefäßen zur Produktion des Signalmoleküls SEMA3A führt, weswegen die „Fenster“ in den Blutgefäßen verschlossen werden. Dies behindert den Fetttransport in Richtung Fettgewebe. In der Fachzeitschrift Nature Cardiovascular Research berichten die Forschenden, dass sich die Fenster wieder öffnen und sich das Fett in der Leber verringert, wenn SEMA3A gehemmt wird.
Im Besonderen kann die „Metabolische Dysfunktion-assoziierte SLD“ (kurz MASLD) aufgrund widriger Lebensumstände wie energiereicher Nahrung und wenig Bewegung entstehen. Sie betrifft weltweit bereits rund ein Drittel aller Menschen. Anfangs hat die MASLD noch keine krankhaften Auswirkungen, sie kann sich aber zu einer Entzündung der Leber weiterentwickeln. Langfristig kann dies zu Leberzirrhose, Leberversagen oder auch Leberkrebs führen. Es gibt kein Ersatzverfahren, das die Funktion der Leber langfristig übernehmen kann, – wie z.B. die Dialyse beim Nierenversagen. Die Betroffenen sind hoch gefährdet und können eventuell nur durch eine Lebertransplantation geheilt werden.
Darüber hinaus tragen MASLD-Betroffene ein erhöhtes Risiko, an Diabetes mellitus Typ 2 zu erkranken oder an Herz-Kreislauf-Erkrankungen zu sterben. Adipositas begünstigt eine MASLD, aber nicht alle adipösen Menschen sind betroffen. Und umgekehrt erkranken auch schlanke Menschen.
Die molekularen Ursachen für die Entstehung einer MASLD sind nicht vollständig bekannt. Ein Forschungsteam der HHU, des DDZ (Leibniz-Zentrum für Diabetes-Forschung an der HHU), des Universitätsklinikums Düsseldorf (UKD) und des Forschungszentrums Jülich (FZJ) hat nun einen wichtigen Aspekt gefunden, der erklärt, wie eine MASLD entsteht.
Die Hauptrolle spielen dabei die sogenannten Fenster (lateinisch Fenestrae) in den Blutgefäßzellen, über die Stoffe zwischen Leberzellen und Blut ausgetauscht werden. Über sie gibt die Leber überschüssige Fettpartikel über den Blutstrom ans Fettgewebe ab.
Die Forschenden fanden heraus, dass diese Fenster durch einen Mechanismus geschlossen werden, bei dem das Signalmolekül SEMA3A (Semaphorin-3A) die zentrale Rolle spielt. Dieses Molekül wiederum wird in Blutgefäßen produziert, wenn sie verstärkt der gesättigten Fettsäure Palmitinsäure ausgesetzt sind.
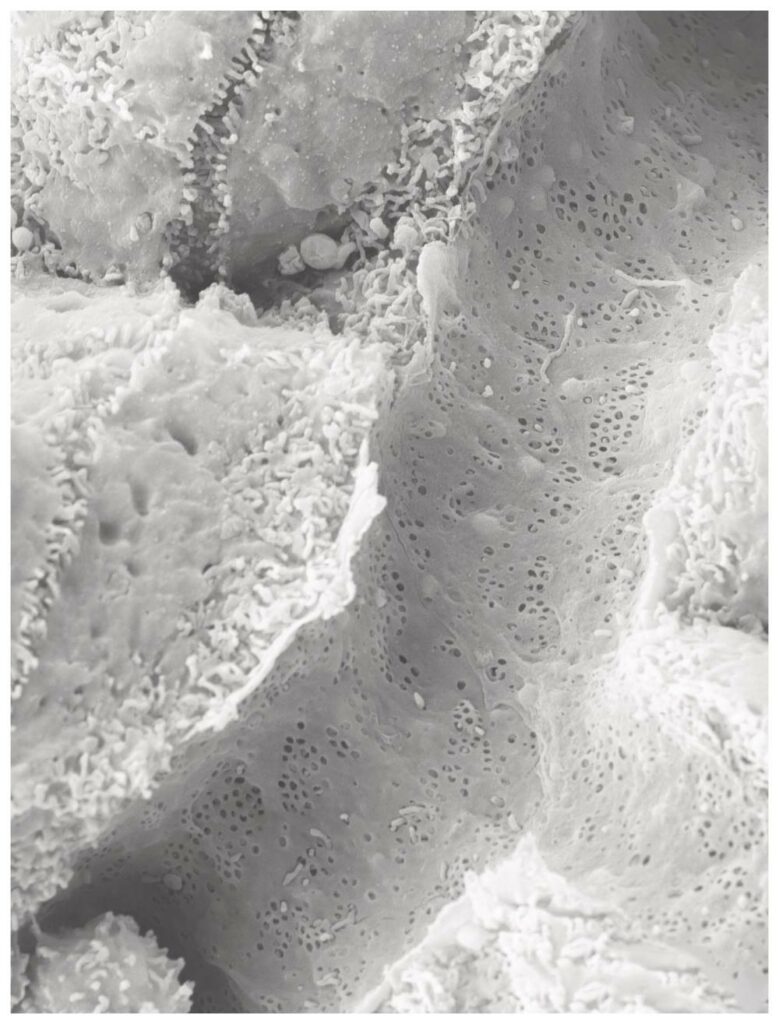
Sydney Balkenhol vom Institut für Stoffwechselphysiologie der HHU und vom DDZ, Erstautorin der jetzt in Nature Cardiovascular Research erschienenen Studie, weist auf eine Entdeckung des Teams hin, die mithilfe der Rasterelektronenmikroskopie gemacht wurde: „Auch in einem speziellen Mausmodell für Fettleber und Typ-2-Diabetes mellitus waren die ‚Fenster‘ in den kleinsten Blutgefäßen der Leber verschlossen.“
Dr. Daniel Eberhard, der weitere Erstautor, ergänzt: „Wir konnten den Effekt auch umkehren. Indem wir das Signalmolekül hemmten, konnten wir die Leber entfetten und so ihre Funktion wieder verbessern.“
Der Korrespondenzautor Prof. Dr. Eckhard Lammert, Leiter des Instituts für Stoffwechselphysiologie an der HHU und des Instituts für Vaskular- und Inselzellbiologie am DDZ, erhofft sich aus den Entdeckungen langfristig einen therapeutischen Ansatz auch für den Menschen: „Möglicherweise kann das von uns identifizierte Signalmolekül SEMA3A genutzt werden, um die MASLD und ihre Folgen frühzeitig zu verhindern. Doch müssen wir zunächst die Prozesse auch beim Menschen näher untersuchen.“
An der publizierten Arbeit waren neben den Arbeitsgruppen von Prof. Lammert auch die Arbeitsgruppen von Prof. Dr. Michael Roden (UKD, HHU und DDZ), Prof. Dr. Irene Esposito (UKD und HHU), Prof. Dr. Timo Dickscheid (HHU und FZJ) und Dr. Bengt-Frederik Belgardt (DDZ) beteiligt. Mit dem Doktoranden Eric Upschulte (FZJ, UKD und HHU) wurden die Fenster in den Blutgefäßen mit Hilfe eines Machine Learning-Ansatzes automatisiert quantifiziert.
Quelle:
Eberhard D, Balkenhol S, Köster A, Follert P, Upschulte E, Ostermann P, Kirschner P, Uhlemeyer C, Charnay I, Preuss C, Trenkamp S, Belgardt B-F, Dickscheid T, Esposito I, Roden M, Lammert E. Semaphorin-3A regulates liver sinusoidal endothelial cell porosity and promotes hepatic steatosis. Nature Cardiovascular Research (2024). https://doi.org/10.1038/s44161-024-00487-z
Über das DDZ:
Das Deutsche Diabetes-Zentrum (DDZ) versteht sich als deutsches Referenzzentrum zum Krankheitsbild Diabetes. Ziel ist es, einen Beitrag zur Verbesserung von Prävention, Früherkennung, Diagnostik und Therapie des Diabetes mellitus zu leisten. Gleichzeitig soll die epidemiologische Datenlage in Deutschland verbessert werden. Federführend leitet das DDZ die multizentrisch aufgebaute Deutsche Diabetes-Studie. Es ist Ansprechpartner für alle Akteure im Gesundheitswesen, bereitet wissenschaftliche Informationen zum Diabetes mellitus auf und stellt sie der Öffentlichkeit zur Verfügung. Das DDZ gehört der „Wissenschaftsgemeinschaft Gottfried Wilhelm Leibniz“ (WGL) an und ist Partner im Deutschen Zentrum für Diabetesforschung (DZD e. V.).
DDZ-Pressebilder dürfen nur für redaktionelle Zwecke unter der Führung des Bildnachweises: „Quelle: Deutsches Diabetes-Zentrum" verwendet werden. Der Abdruck ist honorarfrei. Wir bitten jedoch um Zusendung eines Belegexemplars bzw. einen Hinweis zum Ort der Veröffentlichung.
Ansprechperson am DDZ für weitere Fragen ist:

