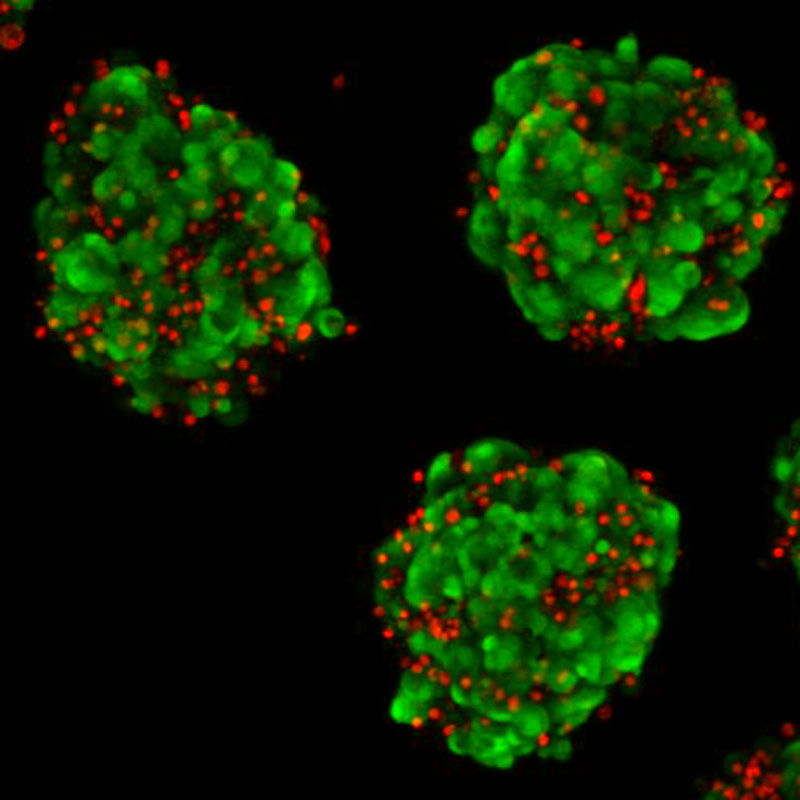
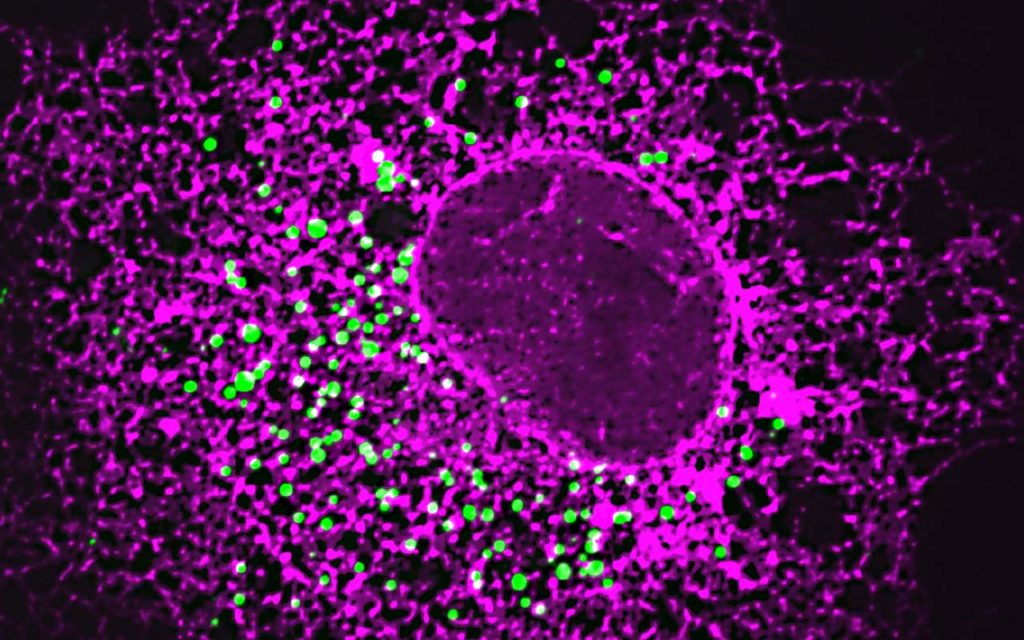
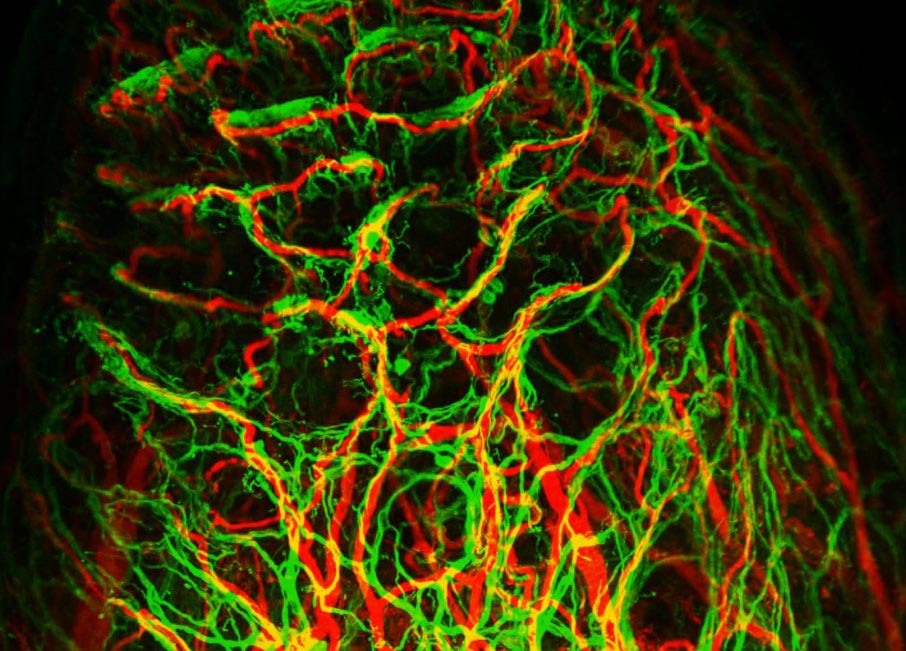
Am Institut für Vaskular- und Inselzellbiologie werden die pathogenen Mechanismen in Betazellen und Endothelzellen während einer Glukoseintoleranz und eines Typ-2-Diabetes untersucht.
Diabetes wird verursacht durch eine Fehlfunktion der Langerhans-Inseln. Langerhans-Inseln sind Zellaggregate und bestehen zu einem großen Teil aus Insulin sekretierenden Betazellen. Ihre Fehlfunktion äußert sich in einer gestörten Insulinsekretion, einem Zelltod sowie einer Dedifferenzierung der Zellen.
Mitarbeiter des Instituts arbeiten an diesen Aspekten der Betazellen und waren die ersten, die zeigen konnten, dass eine fehlende Vaskularisierung der Langerhans-Inseln einen Prädiabetes (also eine Vorstufe des Diabetes) verursacht.
Auch konnte durch das Institut gezeigt werden, dass Blutgefäße für Gewebe, wie z. B. die Langerhans-Inseln oder Leberzellen, wichtige Wachstumsfaktoren in Abhängigkeit vom Blutfluss bereitstellen und somit das Wachstum und den Erhalt der Gewebe beeinflussen.
Schließlich arbeitet das Institut neben den Grundlagen der Langerhans-Inseln und Blutgefäße auch an der Entwicklung neuer Wirkstoffe und Therapien, um den Diabetes und seine kardiovaskulären Folgen besser in den Griff zu bekommen.
Institutsleitung
Ausgewählte Publikationen
- Scholz O, Huß E, Otter S, Herebian D, Hamacher A, Levy LM, Hristeva S, Sanz M, Ajani H, Puentes AR, Hoffmann T, Hogeback J, Unger A, Terheyden S, Reina do Fundo M, Dewidar B, Roden M, Lammert E 2023. Protection of pancreatic islets from oxidative cell death by a peripherally-active morphinan with increased drug safety. Mol Metab. 75. https://doi.org/10.1016/j.molmet.2023.101775
- Pelligra A, Mrugala J, Griess K, Kirschner P, Nortmann O, Bartosinska B, Köster A, Krupenko NI, Gebel D, Westhoff P, Steckel B, Eberhard D, Herebian D, Belgardt B-F, Schrader J, Weber APM, Krupenko SA, Lammert E 2023. Pancreatic islet protection at the expense of secretory function involves serine-linked mitochondrial one-carbon metabolism. Cell Rep. 42. https://doi.org/10.1016/j.celrep.2023.112703
- Griess K, Rieck M, Müller N, Karsai G, Hartwig S, Pelligra A, Hardt R, Schlegel C, Kuboth J, Uhlemeyer C, Trenkamp S, Jeruschke K, Weiss J, Peifer-Weiss L, Xu W, Cames S, Yi X, Cnop M, Beller M, Stark H, Kondadi AK, Reichert AS, Markgraf D, Wammers M, Häussinger D, Kuss O, Lehr S, Eizirik D, Lickert H, Lammert E, Roden M, Winter D, Al-Hasani H, Höglinger D, Hornemann T, Brüning JC, Belgardt B-F 2023. Sphingolipid subtypes differentially control proinsulin processing and systemic glucose homeostasis. Nat Cell Biol. 25: 20–29 . https://doi.org/10.1038/s41556-022-01027-2
- Scholz O, Otter S, Welters A, Wörmeyer L, Dolenšek J, Klemen MS, Pohorec V, Eberhard D, Mrugala J, Hamacher A, Koch A, Sanz M, Hoffmann T, Hogeback J, Herebian D, Klöcker N, Piechot A, Mayatepek E, Meissner T, Stožer A, Lammert E 2021. Peripherally active dextromethorphan derivatives lower blood glucose levels by targeting pancreatic islets. Cell Chem Biol. 28: 1474-1488.e7. https://doi.org/10.1016/j.chembiol.2021.05.011
- Urner S, Planas-Paz L, Hilger LS, Henning C, Branopolski A, Kelly-Goss M, Stanczuk L, Pitter B, Montanez E, Peirce SM, Mäkinen T, Lammert E 2019. Identification of ILK as a critical regulator of VEGFR3 signalling and lymphatic vascular growth. EMBO J. 38. https://doi.org/10.15252/embj.201899322
- Lorenz L, Axnick J, Buschmann T, Henning C, Urner S, Fang S, Nurmi H, Eichhorst N, Holtmeier R, Bódis K, Hwang J-H, Müssig K, Eberhard D, Stypmann J, Kuss O, Roden M, Alitalo K, Häussinger D, Lammert E 2018. Mechanosensing by β1 integrin induces angiocrine signals for liver growth and survival. Nature. 562: 128-132. https://doi.org/10.1038/s41586-018-0522-3
- Kragl M, Schubert R, Haiko K, Otter S, Bartosinska B, Jeruschke K, Weiß J, Chen C, Alsteens D, Kuss O, Speier S, Eberhard D, Müller DJ, Lammert E 2016. The biomechanical properties of an epithelial tissue determine the location of its vasculature. Nat Commun. 7. https://doi.org/10.1038/ncomms13560
- Marquard J, Otter S, Welters A, Stirban A, Fischer A, Eglinger J, Herebian D, Kletke O, Klemen MS, Stožer A, Wnendt S, Piemonti L, Köhler M, Ferrer J, Thorens B, Schliess F, Rupnik MS, Heise T, Berggren P-O, Klöcker N, Meissner T, Mayatepek E, Eberhard D, Kragl M, Lammert E 2015. Characterization of pancreatic NMDA receptors as possible drug targets for diabetes treatment. Nat Med. 21: 363-72. https://doi.org/10.1038/nm.3822
- Konstantinova I, Nikolova G, Ohara-Imaizumi M, Meda P, Kucera T, Zarbalis K, Wurst W, Nagamatsu S, Lammert E 2007. EphA-Ephrin-A-mediated beta cell communication regulates insulin secretion from pancreatic islets. Cell. 129: 359-70. https://doi.org/10.1016/j.cell.2007.02.044
- Lammert E, Cleaver O, Melton D 2001. Induction of pancreatic differentiation by signals from blood vessels. Science (New York, N.Y.). 294: 564-7. https://doi.org/10.1126/science.1064344
- .
Kooperationen
Selektierte externe Kooperationspartner (alphabetisch)
- Boehringer Ingelheim Pharma GmbH & Co. KG, Biberach: Dr. P. Eickelmann, Dr. S.G. Kauschke, Dr. D. Schumann
- Cisanello Krankenhaus, Pisa: Prof. Dr. P. Marchetti, Dr. M. Bugliani
- Harvard Medical School, Boston: Prof. Dr. N. Gray, Dr. Q. Liu, Dr. J. Wang
- Hubrecht Institut, Utrecht: Prof. Dr. S. Schulte-Merker, Dr. F.L. Bos
- Karls-Universität, Prag: Prof. Dr. T. Kucera
- Klinik für Allgemeine Pädiatrie, Neonatologie und Kinderkardiologie, Universitätsklinikum Düsseldorf: Dr. D. Herebian, Dr. J. Marquard, Prof. Dr. E. Mayatepek, PD Dr. T. Meissner
- MPI für Biochemie, München: Prof. Dr. R. Fässler, Prof. Dr. M. Mann
- Osaka Universität, Osaka: Prof. Dr. S. Tsukita
- Profil Institut für Stoffwechselforschung, Neuss: Dr. T. Heise, Prof. Dr. F. Schliess, Dr. A. Stirban
- San Raffaele Wissenschaftsinstitut, Mailand: Dr. L. Piemonti
- Technische Universität Dresden: Prof. Dr. S. Bornstein, Prof. Dr. G. Breier, Dr. S. Speier
- Universität Bremen: Prof. Dr. K. Maedler
- University of British Columbia, Vancouver: Prof. Dr. K.M. McNagny, Dr. M.R. Hughes
- University of California, San Diego: Prof. Dr. Napoleone Ferrara